氨基酸液相分离
蛋白相分离现象
研究表明,在低盐条件下可以发生相分离的蛋白,例如FUS、TDP-43和Brd4等,在高盐浓度下可以重新进入相分离状态。2021年2月17日Tuomas P. J.Knowles,Simon Alberti和Anthony A. Hyman等科学家合作在Nature Communications上发表了题为 “Reentrant liquid condensate phase of proteins is stabilized by hydrophobic and non-ionic interactions“的文章【1】,通过结合实验和模拟,作者证明了在高盐状态下的这种重入相变是由疏水和非离子相互作用驱动的,并且在力学上与低盐状态不同,低盐状态下的凝聚物是通过静电力来稳定的。这些发现对生物分子凝聚物的异常功能、可药性和材料性质具有重要意义。
——重入相变——
本文首次发现FUS蛋白的重入相变现象,即在体外纯化的FUS蛋白表现出两相边界,KCl在125mM以下FUS出现相分离,125mM~1.5M FUS呈现均匀的单一相,1.5M以上FUS重新进入液液相分离状态。而且,高KCl浓度下形成的凝聚物也是完全可逆的(图1)。
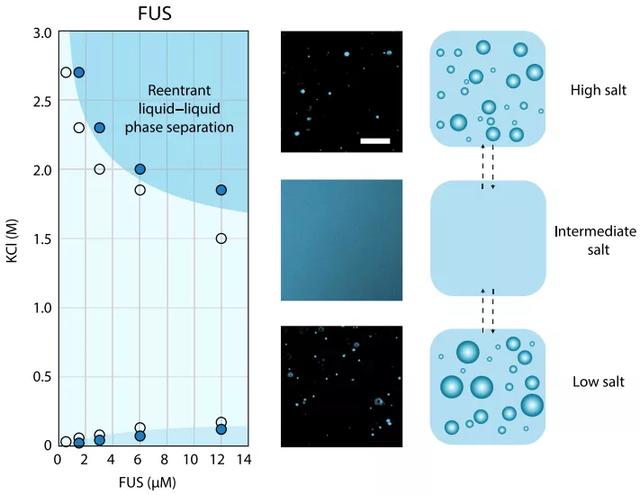
图1. FUS在高盐浓度下的重入相变。
除了FUS,作者发现很多其他蛋白也具有重入相变的现象,如FUS G156E突变体,TDP- 43,Brd4,Sox2和A11(图2)。值得注意的是,高盐下凝聚物的大小和形状与低盐凝聚物相似。对液滴形状的分析表明,低盐和高盐凝聚物都表现出很高的圆度(>95%),并且具有相似的区域分布,证实了它们在两种盐条件下的液体状特征和结构相似。
图2. FUS、FUS G156E、TDP-43、Brd4、Sox2和A11盐介导的重入相变。
——高盐相变的驱动力——
在生理盐浓度及以下FUS的相变,主要是由静电和疏水相互作用驱动的,并且可以被RNA和ATP调节。作者推测高盐浓度下蛋白质的重入相分离,是由于疏水作用增强和离子作用减弱驱动的。如图3,作者考察了一系列充当相分离干扰物的额外组分对于凝聚物的影响。其中,poly-uridine (PolyU) RNA和ATP为带负电的化合物可以干扰静电相互作用,1,6-己二醇干扰疏水相互作用。这3个化合物在低盐下都能破坏FUS的凝聚物,但是在高盐相变的情况下,只有1,6-己二醇可以破坏这些凝聚物。这些观察结果表明,蛋白在高盐下的重入相分离实际上主要是一个疏水驱动的过程。
图3. 利用疏水和静电/极性干扰物对FUS凝聚物进行破坏。
——粗粒化分子动力学模拟——
接下来,作者直接进行了共存模拟,并在粗粒化模型中调制了氨基酸对之间的静电和疏水相互作用的相对贡献。如图4所示,与在低盐条件下的实验一致,作者观察到了FUS的相分离(由于阳离子-阴离子和阳离子-π相互作用),为了确认低盐条件下LLPS对静电力的依赖性,作者缩小了带电相互作用,并如预期的那样,观察到FUS凝聚物的融化(图4c),这一发现证实了静电相互作用在稳定低盐蛋白质凝聚物中的关键作用。最后,在高盐重入相变中,增加疏水相互作用的强度并缩减静电相互作用,作者观察到这种疏水吸引的微弱增强足以导致FUS的重入相变(图4d)。总之,这些结果表明,高盐状态下的蛋白质LLPS是由疏水相互作用驱动的。
图4. 蛋白质粗粒度模型直接共存模拟LLPS对静电和疏水力的依赖性。
——小结——
总的来说,本文通过研究在高盐状态下,疏水性和非离子相互作用对于相变的影响,扩展了控制LLPS的分子语法,并证明了蛋白质相分离的驱动力不仅由氨基酸序列决定,也由环境决定。总之,这些发现可能对生物分子凝聚物的相互作用、成药性和材料性质有广泛的意义,从而拓宽对健康和疾病中生物分子凝聚物行为的理解。
参考文献:
Krainer, G., Welsh, T.J., Joseph, J.A. et al. Reentrant liquid condensate phase of proteins is stabilized by hydrophobic and non-ionic interactions. Nat Commun 12, 1085 (2021).
DOI: 10.1038/s41467-021-21181-9.
「相分离」蛋白质的重入相变依赖于疏水和非离子相互作用,蛋白相分离现象


 添加微信免费咨询
添加微信免费咨询
