DS显示氨基酸残基
【
#新型新冠疫苗有效阻断所有变种感染#】美国加州大学圣地亚哥分校医学院领导的一项新研究,描述了一种制造新冠疫苗的不同方法,这种疫苗在理论上对新出现的变种仍然有效,且可通过鼻吸、药丸或其他方式接种。研究结果发表在21日的《公共图书馆·病原体》在线期刊上。
该研究涉及构建经过基因改造的质粒,以包含一些专门针对新冠病毒刺突蛋白的脆弱性遗传物质,刺突蛋白是病毒的一部分,对结合和感染细胞至关重要。质粒是来自细菌的小的环状DNA分子,它们在物理上与染色体DNA分离且可独立复制。科学家可使用它们将遗传物质从一个细胞转移到另一个细胞,然后引入的遗传物质可在接收细胞中复制。
加州大学圣地亚哥分校医学院教授毛里奇奥·萨内蒂博士说,这种方法指出了一种更持久、更广泛有效的新冠疫苗设计思路。
最新研究强调“质量胜于数量”,寻求诱导抗体优先阻断病毒与其细胞受体的结合和传播,这将导致疫苗产生更集中的抗体反应。新研究将重点缩小到病毒感染能力,这部分在进化上是保守的。换句话说,这些结合位点不会因新变种而改变,而是代表一个持续存在的病毒漏洞和可靠的疫苗目标。
研究团队构建了含有免疫原(导致B淋巴细胞产生抗体的分子)的质粒,这些免疫原是专门设计用于显示作为受体结合基序(RBM)一部分的刺突蛋白的一个节点。这些氨基酸残基就像打开细胞门的钥匙一样,钥匙和锁不会改变。
淋巴细胞是免疫系统的一部分。它们是抗体的巨大生产者,用于响应和抵御体内特定抗原或病毒等不需要的物质。B淋巴细胞每秒平均可吐出1000个抗体分子。
研究团队将选定的刺突蛋白氨基酸克隆到质粒DNA中,当注射到小鼠的脾脏中时,引入的免疫原分子会引发产生中和抗体,专门针对病毒蛋白刺突RBM上的目标进行调节。对带有原始新冠毒株变种的小鼠进行的测试发现,所有变种的免疫反应都相似。
萨内蒂说,将这些发现转化为适合临床试验的疫苗将是“一场艰苦的战斗”。目前的方法投入了大量资金,这是从小鼠研究到人体临床试验的巨大飞跃。(科技日报)
章新政组和许瑞明组合作揭示核小体抑制cGAS激活的调控机制
2020年10月13日,《Cell Research》杂志在线发表了中国科学院生物物理研究所章新政组与许瑞明组合作完成的研究论文”Structural basis for nucleosome-mediated inhibition of cGAS activity”。这项工作解析了人源cGAS(cyclic GMP-AMP synthase)与核小体复合物的冷冻电镜结构,揭示了核小体竞争性抑制cGAS酶活性的结构基础和作用机制,阐释了在细胞核内或特定细胞周期中cGAS不会通过结合自身dsDNA而引起自身免疫系统攻击的原因。
cGAS-STING信号通路是天然免疫系统的重要组成部分,在对抗外源病原体入侵、细胞损伤等过程中发挥着重要作用。cGAS通过识别和结合胞质中的外源dsDNA或细胞损伤产生的自身dsDNA,将底物GTP和ATP催化合成信使小分子cGAMP(cyclic GMP-AMP),cGAMP小分子能够结合并活化STING蛋白,从而激活下游免疫信号通路,介导I型干扰素的产生,引发免疫应答。然而cGAS对DNA的识别没有序列特异性,因此cGAS如何避免被自身正常dsDNA激活是这一研究领域的热点之一。部分研究认为cGAS仅存在于胞质中,但在特定细胞周期如有丝分裂中核膜破裂将会有大量自身DNA被释放出来;其他研究认为细胞核中也有cGAS存在,并且cGAS在染色质区域富集。然而在上述两种情况中,cGAS的酶活性均处于抑制状态。近期有研究表明核小体能够与cGAS结合并抑制dsDNA介导的cGAS激活,然而具体的作用机制尚不清楚。
章新政课题组与许瑞明课题组就此展开密切合作,进一步验证了核小体能够竞争性与cGAS结合并抑制其酶活性,成功获得了两种人源cGAS与核小体复合物的冷冻电镜结构,分别以1:1和2:2形式结合(图1)。cGAS拥有三个dsDNA结合位点(site A/B/C),并且这三个结合位点均对dsDNA所介导的cGAS激活具有重要作用。在人源cGAS-核小体复合物结构中,研究者发现cGAS以单体形式与核小体结合,其结合位点site B与核小体H2A-H2B的酸性界面之间存在紧密相互作用,结合位点site C中的碱性氨基酸残基则可与相邻核小体的DNA结合。由于空间位阻效应,cGAS的结合位点site A虽然没有直接参与与核小体之间的结合,但这一区域亦不能被DNA靠近结合。因此,核小体与cGAS之间的相互作用充分阻挡了cGAS与DNA之间的识别与结合,破坏了cGAS二聚化,从而将其”绑架”在非激活的单体状态。除此之外,研究者发现cGAS能够与核小体结合形成更为高级形式的寡聚体复合物,并成功获得了以4:3比例结合的cGAS-核小体复合物电子密度图。在这项工作中,研究者通过一系列体外结合实验和酶活性实验,验证了核小体抑制cGAS激活的关键氨基酸残基,以及介导高级形式复合物形成的相互作用区域。
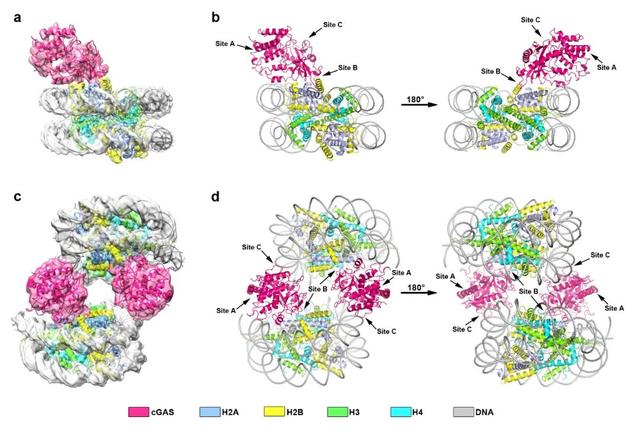
图1. 人源cGAS与核小体复合物的冷冻电镜结构示意图。
中国科学院生物物理研究所章新政研究员和许瑞明研究员为该项工作的共同通讯作者,章新政组副研究员曹端方、许瑞明组博士后韩晓楠和章新政组博士研究生范晓益为共同第一作者。这项工作得到了国家重点研发计划、国家自然科学基金、中国科学院战略性先导计划和中科院青年创新促进会的资助和支持。
文章链接:
https://www.nature.com/articles/s41422-020-00422-4

2019年热文TOP10
1. 逆转2型糖尿病的大牛又发文了:2型糖尿病是简单的疾病,减肥或逆转病情!
2. 刚刚,Science发布2019十大科学突破!
3. Science重磅!西兰花“唤醒”抗肿瘤基因
4. 读者泪目!《柳叶刀》全中文发表中国医学博士「家书」:给父亲的一封信
5. 《Science》重磅!汝之“蜜糖”,吾之“砒霜…”
6. 喝酒,尤其还脸红的人,或面临更高的痴呆风险
7. Nature重磅!第一个完全合成且彻底改变DNA密码的生物诞生了
8. 这不是一颗大榛子!Science发表新型口服胰岛素,或将取代传统注射
9. Science为防秃顶支招:先从不脱发开始…
10. 改变精子速度,可以影响后代性别?
章新政组和许瑞明组合作揭示核小体抑制cGAS激活的调控机制
【研究发现
#动辄大打出手或与基因突变有关#】
#研究称有攻击行为的人体内可能发生了基因突变#人群中,有人温文尔雅,有人暴虐无常。最新研究发现,那些有攻击行为的人,体内可能发生了基因突变。记者16日从南京大学获悉,该校医学院石云教授团队联合中外学者研究发现,编码大脑内谷氨酸受体GluA3的GRIA3基因突变,会引起人类攻击行为。该成果近日发表于国际精神病学领域旗舰学术期刊《分子精神病学》。
论文的共同通讯作者、南京大学医学院教授石云介绍,在过去的研究中,研究人员发现,将X染色体上编码谷氨酸受体GluA3的GRIA3基因从雄性小鼠体内敲除,小鼠会表现出强烈的攻击行为。所以,人类的同源基因GRIA3被学界普遍认为是人类攻击行为的易感基因之一。然而迄今为止没有直接证据表明GRIA3基因和人类的攻击行为相关。
“此次研究,我们在4个有突发攻击行为的欧洲患者中,发现他们携带有GRIA3基因的罕见变体,其中3个患者的GRIA3基因突变,导致GluA3谷氨酸受体发生G630R的氨基酸残基变化,另一个患者的基因突变导致了E787G的变化。功能检测表明,这两种突变都造成GluA3功能的丧失,相当于信号接收器坏了。”石云解释,也就是说,谷氨酸结合到突变的GluA3受体上,不能有效传递神经信号,因此初步判断人类GluA3的功能损坏会导致攻击行为,这和基因敲除小鼠的行为一致。
除了基因突变的病人,在普通人群中是否存在影响GluA3表达水平的遗传因素,诱发了攻击行为?
该论文的第一作者彭世笑说,研究人员在GRIA3基因的192个高频单核苷酸多态性位点中,发现rs3216834位点为连续的鸟苷酸重复序列,在人群中约78%的人带有9个鸟苷酸(9G),少数人带有7G、8G、10G和11G。实验表明,10G或11G的长的鸟苷酸重复序列会严重抑制GluA3受体的表达水平。
随后,研究者在294位男性暴力犯罪服刑人员中发现9人携带rs3216834-10G,另有1人携带11G,占总体的3.4%。而在没有犯罪记录的937位社区男性中,仅有2人携带10G(0.2%),并且没有发现11G的携带者。
“这说明rs3216834-10G、11G的携带者在暴力犯罪服刑人员中远高于正常对照人群,而10G和11G严重抑制GluA3的表达,增加了攻击行为的发生风险。”石云介绍。
为了进一步分析GluA3受体损坏或表达降低诱发攻击行为的神经机制,研究人员分析了GRIA3基因敲除小鼠,发现小鼠的内侧前额叶皮层的神经活动减低。而将前额叶皮层的GluA3补偿回去,可以显著缓解敲除小鼠的攻击行为。
“这意味着前额叶皮层异常的神经活动是攻击行为的关键神经环路机制。”石云认为,这项研究揭示了人类攻击行为新的遗传因素,这对于缓解攻击行为的药物研发,或可提供参考。(科技日报;艾塔)


 添加微信免费咨询
添加微信免费咨询
