撰文 | Leon
责编 | 雪月
SARS-CoV-2通过S蛋白(spike)三聚体识别受体ACE2来感染细胞。在这个过程中,S蛋白会被宿主的蛋白酶(如TMPRSS2)切割为S1和S2两部分,分别介导受体结合和膜融合过程。S1由N-terminaldomain(NTD)和receptor binding domain(RBD)组成。RBD负责与ACE2结合,而NTD的功能尚不清楚。先前的研究已经指出,MERS-CoV的S蛋白的NTD可作为抗原表位被中和抗体识别【1】。
2020年6月22日,军事医学科学院的陈薇、李建民联合西湖大学的周强团队在Science杂志上发表了题为A neutralizing human antibody binds to the N-terminal domain of the Spike protein of SARS-CoV-2 的论文。研究者从COVID-19康复者身上找到结合NTD而不是RBD的抗体,测定了它们的中和能力,并用冷冻电镜分析了抗体与NTD间的相互作用。
实验人员从10位COVID-19康复者身上收集了血浆和外周血单核细胞(peripheral blood mononuclear cells,PBMCs),分离出单克隆抗体,并且用酶联免疫吸附(ELISA)的方法测定了这些抗体与S蛋白的结合(图1)。
图1. 单克隆抗体的结合曲线。CR3022是已报道的抗体,可结合SARS-CoV/SARS-CoV-2的RBD(ECD即胞外结构域,extracellular domain)
紧接着,作者用Vero-E6细胞的真病毒检测了这些抗体的中和能力,其中三株抗体展现出中和活性,1M-1D2、4A8和0304-3H3的EC50分别是28,0.61和0.04 μg/mL。CR3022并不能中和真病毒,而另一株抗体2M-10B11结合RBD的EC50为5ng/mL,但是也不能中和真病毒。这表明单克隆抗体对RBD的亲和力与中和能力并不完全相关。用qRT-PCR检测Vero-E6细胞的病毒RNA后发现,0304-3H3和4A8对病毒的抑制能力强于1M-1D2。
然后,实验者用生物膜层干涉(bio-layerinterferometry,BLI)量化了抗体与S蛋白的结合。4A8和1M-1D2结合S1的KD值为92.7 nM和108 nM,0304-3H3和9A1结合S2的KD值为4.52 nM和< 0.001nM,2M-10B11结合RBD的KD为24.3 nM。与预期一致,在这些抗体中,只有2M-10B11能够阻止S蛋白与ACE2的结合。
接下来,作者分别表达纯化了抗体4A8和S蛋白的胞外结构域,两者混合后用冷冻电镜解析了复合体结构,整体分辨率3.1 ?(图2)。尽管三个S蛋白单体的构象不同,但4A8和每个NTD的结合模式是相同的。
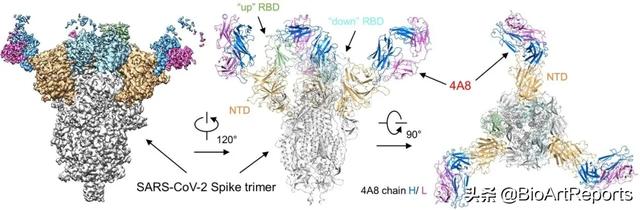
图2. 4A8的重链和轻链分别为蓝色和品红表示。S蛋白三聚体的NTD为橙色,一个RBD处于“up”的状态,两个RBD为“down”,分别用绿色和青色表示。
NTD的两个loop区域与4A8有相互作用,分别是N3(141-156位氨基酸)和N5(246-260位氨基酸)。作者还在NTD鉴定出三个新的糖基化位点(Asn17,Asn61,Asn149)。4A8的重链主要通过三个complementarity-determiningregions(CDRs)与NTD结合,分别为CDR1(25-32位氨基酸)、CDR2(51-58位氨基酸)和CDR3(100-116位氨基酸)(图3)。此外,NTD的Asn149的糖基化位点靠近4A8-NTD界面,提示N-聚糖可能参与了蛋白间相互作用。
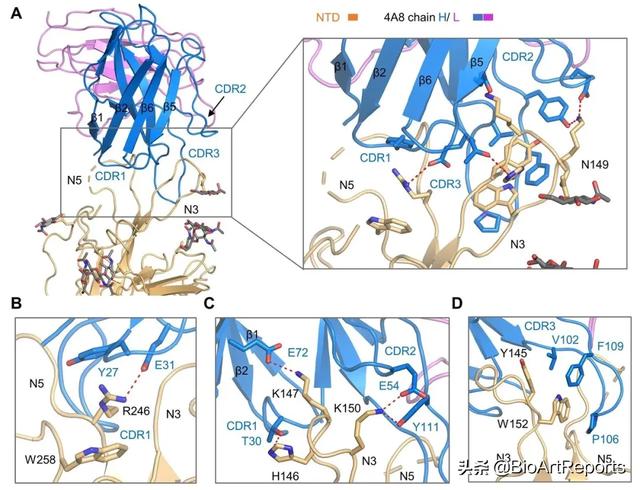
图3. NTD和4A8之间的相互作用
这项工作中,作者发现的许多抗体并不结合RBD,但也可以起到中和作用,说明病毒感染并不仅仅依赖于S蛋白和ACE2的结合。针对SARS-CoV-2的S蛋白的单克隆抗体是治疗COVID-19的重要手段,许多靶向RBD的抗体已经被鉴定出来【2-5】。单独使用靶向RBD的抗体可能会诱导病毒的抗性突变【1】,而抗体的“鸡尾酒疗法”可能避免这个问题,联用多种针对不同抗原表位的抗体可能更有治疗的潜力。
原文链接
https://science.sciencemag.org/content/early/2020/06/19/science.abc6952
参考文献
1. H. Zhou, Y. Chen, S. Zhang, P. Niu, K. Qin, W. Jia, B. Huang, S.Zhang, J. Lan, L. Zhang, W. Tan, X. Wang, Structural definition of an neutralization epitope on the N-terminal domain of MERS-CoV spike glycoprotein. Nat. Commun. 10, 3068 (2019). doi:10.1038/s41467-019-10897-4pmid:31296843
2. C. Wang, W. Li, D. Drabek, N. M. A. Okba, R. van Haperen, A. D. M.E. Osterhaus, F. J. M. van Kuppeveld, B. L. Haagmans, F. Grosveld, B.-J. Bosch,A human monoclonal antibody blocking SARS-CoV-2 infection. Nat. Commun. 11,2251 (2020). doi:10.1038/s41467-020-16256-ypmid:32366817
3. X. Chen, R. Li, Z. Pan, C. Qian, Y. Yang, R. You, J. Zhao, P. Liu,L. Gao, Z. Li, Q. Huang, L. Xu, J. Tang, Q. Tian, W. Yao, L. Hu, X. Yan, X.Zhou, Y. Wu, K. Deng, Z. Zhang, Z. Qian, Y. Chen, L. Ye, Human monoclonal antibodies block the binding of SARS-CoV-2 spike protein to angiotensin-converting enzyme 2 receptor. Cell. Mol. Immunol. 17, 647–649 (2020).doi:10.1038/s41423-020-0426-7pmid:32313207
4. Y. Wu, F. Wang, C. Shen, W. Peng, D. Li, C. Zhao, Z. Li, S. Li, Y.Bi, Y. Yang, Y. Gong, H. Xiao, Z. Fan, S. Tan, G. Wu, W. Tan, X. Lu, C. Fan, Q.Wang, Y. Liu, C. Zhang, J. Qi, G. F. Gao, F. Gao, L. Liu, A noncompeting pair of human neutralizing antibodies block COVID-19 virus binding to its receptorACE2. Science 368, 1274–1278 (2020). doi:10.1126/science.abc2241pmid:32404477
5. Y. Cao, B. Su, X. Guo, W. Sun, Y. Deng, L. Bao, Q. Zhu, X. Zhang, Y.Zheng, C. Geng, X. Chai, R. He, X. Li, Q. Lv, H. Zhu, W. Deng, Y. Xu, Y. Wang,L. Qiao, Y. Tan, L. Song, G. Wang, X. Du, N. Gao, J. Liu, J. Xiao, X. D. Su, Z.Du, Y. Feng, C. Qin, C. Qin, R. Jin, X. S. Xie, Potent neutralizing antibodies against SARS-CoV-2 identified by high-throughput single-cell sequencing of convalescent patients’ B cells. Cell (2020). doi:10.1016/j.cell.2020.05.025pmid:32425270


 添加微信免费咨询
添加微信免费咨询
