氨基酸残基结构
#科学燃计划##科学前沿#【AlphaFold精准预测蛋白结构】
蛋白质三维结构预测是生物学最严峻的挑战之一。继围棋、国际象棋等竞技项目之后,近日谷歌旗下DeepMind开发的人工智能程序AlphaFold在两年一次的蛋白质结构预测挑战赛CASP中再次大幅胜出。该程序在根据蛋白质氨基酸序列确定蛋白质三维结构方面取得巨大飞跃,准确性可与冷冻电子显微术(又称冷冻电镜)(Cryo-EM)和X-射线晶体学等实验技术相媲美。
第一代AlphaFold依托蛋白质数据库PDB作为训练数据集,构建神经网络,采用深度学习预测氨基酸残基间的方向和距离,混合传统算法Rosetta对蛋白质结构进行同源建模、结构优化;与此不同的是,第二代AlphaFold则将折叠蛋白质视为“空间图”,基于神经网络系统进行“端到端”的训练,使用了进化相关的氨基酸序列,多序列比对以及对氨基酸对的评估来优化结构预测。研究人员使用蛋白质数据库中接近17万个不同的蛋白质结构,通过不断地迭代,AlphaFold系统学习到了基于氨基酸序列精确预测蛋白结构的能力。这一基于原子坐标近乎“暴力”的算法是全新的途径,是全新算法与强大算力的强强联合。
正如马里兰大学帕克分校计算生物学家,CASP共同创始人John Moult所言,从某种程度上而言,结构预测问题得到了解决。根据氨基酸序列准确预测蛋白质结构的能力将对生命科学和医学带来巨大的好处。这将极大地加快对细胞组成模块的理解,对于更快更先进的药物发现显然有很大帮助。Nature使用“它将会改变一切”来报道这一关键成果,研究人员之间也衍生出了“结构生物学家要失业了”的调侃。
然而,事实上,结构生物学研究或许反而会更上一层楼。AlphaFold部分结构预测的精度确实可与实验测定方法相媲美,这其中也不乏复杂超长的结构。但生物体环境是复杂的,体内蛋白质折叠结构受到更加复杂因素的影响,其使用的数据集也多来自于过去的静态结构测定方法;并且AlphaFold目前预测复杂蛋白复合物结构的能力还十分有限,在体内,最低能量状态则并非唯一的决定因素;而实验测定方法的确会受到蛋白质生物物理特性的局限导致无法获得蛋白复合物的完整结构,比如难以结晶的膜蛋白,但“眼见为实”为功能机制理解、药物开发、蛋白设计提供了扎实的实验证据,是不可缺失的一环。因此,AlphaFold的结构预测手段和实验测定手段可以相辅相成,成为实验科学家更有力的手段,共赢大于竞争。正如《返朴》总编、结构生物学家颜宁及其他大咖对此的深刻评议与发言:结构生物学的主语是生物学,是理解生命、是为了回答问题,做出生物学发现。
AlphaFold的表现证明了AI在辅助基础科学发现方面惊人的潜力。但“改变一切”过于乐观,也言之尚早,AlphaFold目前还不能预测复杂的分子机器,蛋白-蛋白相互作用非常复杂,存在极多的可能性。实验手段所揭示出来的蛋白-蛋白相互作用方式也还只是冰山一角,更何况在不同生理条件和过程中的结构变化。AlphaFold确实可以加快可成药靶点配体的发现速度,但对于新药发现而言,基于结构寻找合适配体只是第一步,先导化合物的选择性、过膜性、稳定性等成药性质的优化仍然需要大量的工作。
正如DeepMind团队在公司发布的博文中表示,他们相信,AI将成为人类拓展科学知识前沿最有力的工具之一!我们也相信,并且十分期待AlphaFold更加完美的表现!
?
参考链接:
1. 网页链接
2.网页链接
3.网页链接
4.药明康德《解决生物学50年来的重大挑战!生物界“AlphaGo”精准预测蛋白质结构》
5.返朴《颜宁等点评:AI精准预测蛋白质结构,结构生物学何去何从?》
西湖大学研究团队又获重大突破:深度解密新冠病毒侵染人体一刻
来源:浙江新闻客户端
版权归原作者所有,如有侵权请及时联系我们
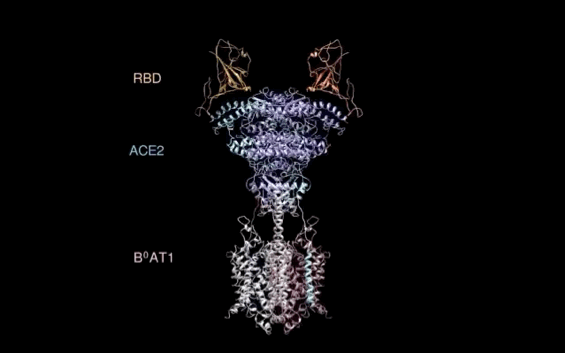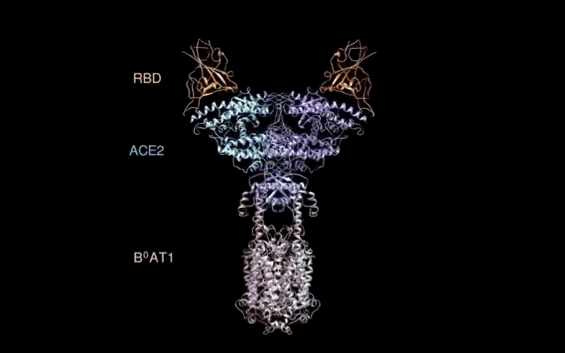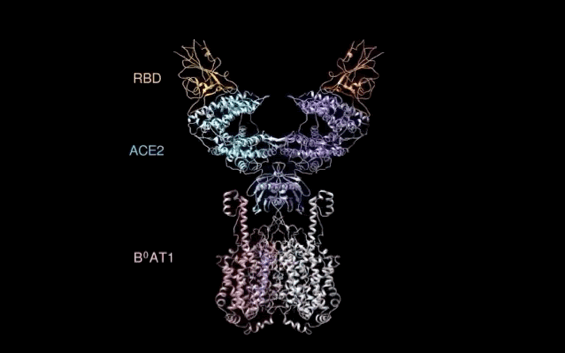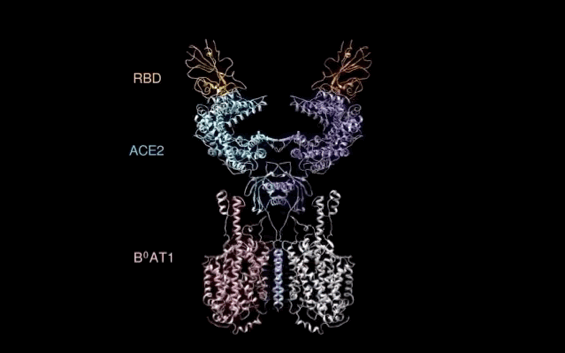
西湖大学周强实验室再次取得重大突破。
北京时间2月21日凌晨,周强研究团队在论文预印本网站BioRxiv再次发文,报道新冠病毒表面S蛋白受体结合结构域与细胞表面受体ACE2全长蛋白的复合物冷冻电镜结构,揭开了新冠病毒入侵人体细胞的神秘面纱。
就在2天前,该团队刚刚在bioRxiv上首次发布了新冠病毒受体ACE2全长结构。
这两篇预印本论文的第一作者为西湖大学生命科学学院博士后鄢仁鸿,通讯作者为西湖大学生命科学学院研究员周强。第一单位和通讯单位均为西湖大学浙江省结构生物学研究重点实验室。这也是西湖大学承担的浙江省“新型冠状病毒肺炎防治应急攻关项目”取得的重要成果,得到浙江省、杭州市相关部门和西湖区的大力支持。

侵入——
病毒“劫持”人体蛋白
ACE2中文名称“血管紧张素转化酶2”。它作为膜蛋白,广泛存在于人体的肺、心脏、肾脏和肠道的细胞中,控制人体血压平衡。S蛋白则存在于冠状病毒的刺突之上。SARS病毒和新冠病毒均属于冠状病毒。
新冠病毒S蛋白有如“强盗”,会“劫持”ACE2作为“人质”。
疫情爆发后,武汉病毒研究所的科学家发现,新冠病毒和SARS病毒一样,也是通过识别ACE2进入人体细胞的。ACE2作为病毒的受体,是新冠病毒侵入人体的关键。
西湖大学特聘研究员陶亮进一步比喻:“我们可以把人的身体比喻成一个房屋。ACE2就像是房屋的‘门把手’。在新冠病毒侵入人体的过程中,S蛋白通过抓住‘门把手’,便打开了进入人体细胞的大门。”
最近美国得克萨斯大学奥斯汀分校的研究团队展示了新冠病毒的S蛋白全长结构。
然而,ACE2到底在细胞膜上是以什么状态存在?新冠病毒对比SARS病毒与ACE2结合有何异同?
要解答这些问题,仅解析“敌人”的相貌还远远不够。

聚焦——
看清“敌我”,百战不殆
要想百战不殆,知彼,也需知己。看清存在于人体内的ACE2的完整蛋白结构,就看清了自己。
获得ACE2的全长蛋白结构,因而也是研究团队攻坚的第一步。
ACE2难以在体外稳定获得。周强以及鄢仁鸿在大量的文献中发现,ACE2与肠道内的一个氨基酸转运蛋白B0AT1可以形成复合物。经试验,他们获取了ACE2与B0AT1优质稳定的复合物,从而取得了ACE2的全长蛋白结构。
基础科学的成果并非一蹴而就。过去两年,周强实验室一直在研究人源氨基酸转运蛋白,他们锁定了数种目标蛋白,ACE2就是其中一种。而后,新冠肺炎疫情爆发,周强团队迅速将ACE2研究工作的优先级提升,以最快速度取得研究成果,为后续药物设计和研发提供关键信息。
通过分析ACE2的全长蛋白结构,周强实验室发现ACE2以二聚体形式存在,同时具有开放和关闭两种构象变化,但两种构象均含有与新冠病毒的相互识别界面。
“总体而言,ACE2全长结构的解析,将有助于理解冠状病毒进入靶细胞的结构基础和功能特征,对发现和优化阻断进入细胞的抑制剂有重要作用”,清华大学全球健康与传染病研究中心主任张林琦教授说。
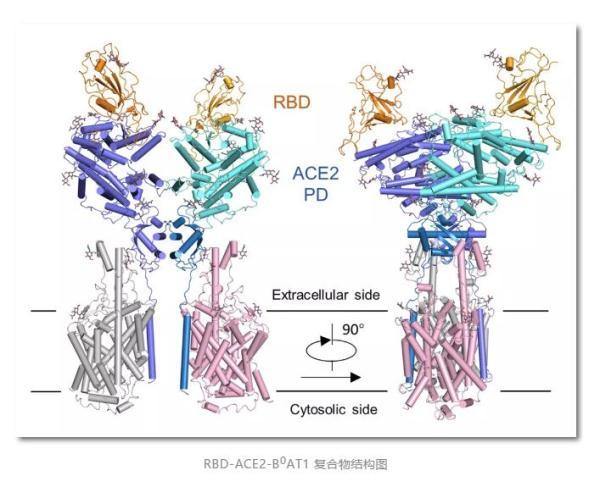
推进——
复原病毒“开门”一刻
有了ACE2全长蛋白结构,周强实验室进而解析了全长ACE2与新冠病毒S蛋白受体结合域的复合结构。
记者在周强实验室的电脑上,看见到了最新获取的复合结构界面图。随着鼠标的拖动,图片展示出不同角度的三维透视效果。
“它相当于全方位展示了新冠病毒S蛋白握住‘门把手’那一刻时,病毒和ACE2的状态。”周强说。
那么,这次解析出来的复合物结构上透露了什么?
周强实验室研究团队发现,新冠病毒的S蛋白看似一座桥横跨在ACE2表面,又像病毒的一只手,紧紧抓住ACE2。这一点与SARS病毒侵入的样子很相似。
而且,新冠病毒S蛋白的受体结合结构域与SARS病毒的序列也非常像,相似性达到82%。但进一步分析又发现,对比SARS与ACE2的相互作用,新冠病毒S蛋白与ACE2结合的氨基酸残基中,有一部分发生了较大改变。
“这也许可以解释为什么新冠病毒和SARS病毒与ACE2的结合能力不一样。这种结合能力可能影响了病毒的传染力。”不过,影响究竟是增强还是减弱,周强表示,还需要通过其他实验手段验证。

作用——
为药物设计提供有力帮助
科研要知其然,也要知其所以然。获取病毒“开门”一刻,并对此进行分析,将对防疫抗疫产生重要意义。
“知道锁孔长啥样,然后照这个配钥匙。不然就要用无数个钥匙去试哪个可以开门。” 一位网友曾如此评价这项研究的价值。
换言之,看清了“锁孔”,就可找到一个匹配的“盾牌”堵住它。人体的大门也就不会被病毒打开。
此前有研究显示:每个冠状病毒的S蛋白上,约有1300多个氨基酸。新冠病毒S蛋白上,有300多个氨基酸负责与ACE2相互作用。相当于这些氨基酸共同握着能够打开人体大门的钥匙。
有没有可能模拟一种蛋白,不是病毒,又能把受体先饱和住,从而阻拦病毒与受体的相互作用?有没有可能把受体与病毒结合的表面进行优化,并且把它转移到某个抗体的骨架上,从而设计出更加强有力的综合抗体,作为抑制病毒的手段?
“理解了新冠病毒侵染细胞的机理,就是希望为药物设计提供有力的帮助。”周强认为,在解析全长ACE2与新冠病毒S蛋白受体结合域的复合结构的基础上,许多进一步的探索都将有了一些方向。
声明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。
西湖大学研究团队又获重大突破:深度解密新冠病毒侵染人体一刻
肺鳞癌驱动基因获重大突破!
近日,《自然》发布:研究发现Nsd3是肺鳞癌的驱动基因之一。
NSD3驱动基因的机制是什么?
NSD3是组蛋白甲基转移酶,它通过给组蛋白H3的第36位氨基酸残基(H3K36)加两个甲基。如果NSD3水平增加,或者活性增强(例如T1232A变异),就会导致H3K36被过度甲基化。
咱们的基因组在细胞核里面都是缠绕在组蛋白上的,组蛋白的表观遗传学修饰(例如甲基化)会像“开关”一样,影响周边基因的表达。
而NSD3对H3K36的双甲基化修饰,会导致附近促癌基因的表达开关被打开,进而驱动肺鳞癌的进展。
但是目前临床上还没有NSD3抑制剂。
于是研究人员又在一个抑制剂库里筛选能抑制NSD3活性的药物。结果找到了4种溴原子抑制剂(BETi),小鼠实验表明,肺鳞癌确实对BETi敏感。
总而言之,这项研究成果确定了NSD3是肺鳞癌的驱动因素,为开发治疗肺鳞癌的靶向药物找到了合适的靶点。
全球每年有10万肺鳞癌患者体内存在8p11-12片段的扩增。另外,乳腺癌和其他恶性肿瘤中也常见8p11-12片段的扩增。
期待抑制NDS3相关药物早日进入临床研究阶段。
2 FGFRI纤维母细胞生长因子受体1 突变比例约4%(4/95),家族成员(包括FGFR1
FGFR2, FGFR3。FGFR4,是一种酪氨酸跨膜激酶受体。目前的临床试验已宣告失败。
2 PI3KCA基因的扩增远较突变常见,鳞癌可以高达33.1%,而腺瘤(6.2%)和小细胞瘤(4.7%)。
目前针对P3KCA基因突变的单药1期研究,包含肺癌、乳腺癌、结直肠癌等多种癌症。
4 DDR2盘状结构域受体(discoidin domain receptor 2, 中与在恶性黑色素宿中的常见突变V600E不同,值得进DDR2) 肺鳞痛DDR2突变率虽然不高,一项针对DDR2突变
肺鳞癌的临床研究已经结束人组(NCT 01491633 ),若研究发现肺鳞癌DDR2突变者对达沙替尼确实有效,将会对该亚型患者治疗带来突破性的研究进展。
5 MET基因扩增MET基因是一种编码HGFR蛋白原癌基因,是一种酪氨酸激酶膜受体,位于染色体721-q3,其与配体肝细胞生长因子( hepatocyte grow factor, HGF)均促进肿瘤发生1″, MET扩增可见于懒癌和腺癌、MET扩增与EGFR-TKI继发耐药有关,有报道认为是通过激话ERBB-3通路相关。尽管有报告认为在肺癌的扩增比例约3%-21%,但由于这是一种低水平的扩增,有学者认为突变的比率要低的多,估计肺鳞癌为1%,腺癌为2%
多项MET抑制剂正研究中,目前的研究一般均针对MET过表达的NSCLC.并非仅针对解癌。例如:克唑替尼是MET和ALK的双重抑制剂;多把点药物cabozantinib(XL184)以MET, RET和VEGF2为靶点0 Tivatinib(ARQ197)则是以MET为靶点的小分子药物,但有一定的细胞毒性1;而单克隆抗体MetMAb联合厄洛替尼治疗复治NSCLC。
6 BRAF BRAF是KRAS下游的丝氨酸/苏氨酸激酶,将sRAS鸟,苷三瞬酸连接到丝裂原活化蛋白激酶家族的下游蛋白,控制细胞增殖. RAF激商家族包括3个成员:ARAF, BRAF IRAFI (也称为CRAF) , BRA突变与酶活性增加相关,导致MAPK2HMAPK3组成型活化。
总之,目前EGFR-TKI的出现使得肺癌的靶向治疗成为现实,但针对肺鳞癌的靶向治疗研究进展相比腺癌明显比较慢,到目前为止尚未开展一项1期临床研究。目前也仅发现约40%肺鳞癌患者携带不同的驱动基因,还有相当多的聚动基因未被发现,肿瘤的形成是一个多基因参与的异常复杂的过程,现有的靶向药物如小分子激酶扣制剂大多是针对一个靶点而设计,因此只有发现更多的驱动基因,阐明基因之间的相互作用关系,开发出更多的靶向药物,联合应用或联合其它的治疗方式,才有可能收到理想的疗效。
总之,真正实现肺鳞癌的个体化靶向治疗仍然任重而道远。


 添加微信免费咨询
添加微信免费咨询
