氨基酸科学前景
日本小行星探测器“隼鸟2号”从小行星“龙宫”带回地球的沙子样本中,发现了氨基酸。这是首次在地球以外确认氨基酸的存在。氨基酸是组成生命的必要条件,发现地外氨基酸说明距离发现地外生命已经不远了。一颗普通的小行星上都能发现氨基酸,由此大致看出,地外生命在宇宙中应该是普遍存在的,并没有想象中那么稀有。
那么,根据费米悖论,人类 m的前景可能不太乐观了。因为如果宇宙中生命普遍存在,但到目前为止人类没发现任何生命迹象,那么大概率只有两种可能,第一种可能是绝大多数都是低级生命,不能向太空发射信号,很难发现,智慧文明极其稀有,整个银河系可能就人类是智慧文明。第二种可能是智慧文明很多,但都在诞生不久后很快就灭绝了,人类和其他智慧文明生存的时间线都错开了,那这就意味着人类很可能也会灭绝。但愿真相不是第二种。
新纪录!西湖大学利用氨基酸实现高储能
◎ 通讯员 徐珊 科技日报记者 刘园园
为满足人类能源需求,发展清洁的可再生能源已是大势所趋。而高效地利用可再生能源,又依赖储能技术的发展。
记者1月20日从西湖大学了解到,西湖大学理学院特聘研究员王盼课题组及其合作团队利用氨基酸发展了新型仿生设计水溶性吩嗪类化合物,赋予水系有机液流电池体系极低的电池容量衰减。
该研究提供了一种新型高稳定性水系有机分子结构骨架设计策略,为进一步设计构建高性能水系液流电池提供了重要理论依据。这一最新成果日前作为封面文章发表于《德国应用化学》期刊。

水系有机液流电池,发展新趋势
“作为液流电池的一种,水系有机液流电池使用水作为介质,是具有较高安全性的储能系统。” 王盼说,液流电池可以将电能转化为化学能进行储存,它通过活性物质在电极表面发生氧化还原反应来储存和释放能量。

西湖大学理学院特聘研究员王盼(第二排右一)及其团队
研究人员介绍,水系有机液流电池的活性材料,来源于自然中储量丰富的碳、氮、氧等元素,这些元素在分子结构上可编辑可调节,能够通过有机官能团得失电子的氧化还原行为,完成化学能与电能的相互转化。
而有机分子中的多电子转移及其多样的可设计性,赋予了水系有机液流电池独特灵活的优势,使之成为液流电池发展的新趋势。
“在水系液流电池领域,一系列基于蒽醌、紫罗碱、二茂铁、氮杂芳环等有机结构骨架的分子,已展现了较为良好的性能和应用前景。” 王盼说,然而,目前绝大部分研究工作都是基于商业可得的已知功能染料分子;基于吩嗪类有机结构骨架的衍生物,在前序报道中仅有几个例子,均存在水溶性差和不稳定等问题,且该类化合物衰减机理尚不明确。

氨基酸功能化吩嗪衍生物(AFP)的合成
年衰减0.5%,水系有机液流电池新纪录
为改进现状,西湖大学研究人员将目光投向自然界来源广泛的氨基酸。
该课题组将氨基酸作为功能化基团引入吩嗪骨架,利用氨基酸的水溶性特点及给电子特性,合成了一系列水溶性吩嗪类衍生物(AFP)。之后,研究人员系统地探究了“AFP家族”不同成员——即不同支链及不同位置的氨基酸——对水系液流电池性能的影响。
“简版”水系液流电池系统
“研究表明,1,6-AFP具有稳定的氧化态和还原态;1,8-AFP、2,7-AFP同样具有稳定的氧化态,但其还原态易于发生氢的互变异构,失去氧化还原活性并进一步降解,在电池测试中其容量迅速衰减。”王盼介绍。
课题组还对该类化合物的衰减机制做了详尽分析。研究发现,明星分子1,6-AFP在pH8,1M电子浓度下,在水系液流电池长时间的恒压充放循环过程中表现优异。
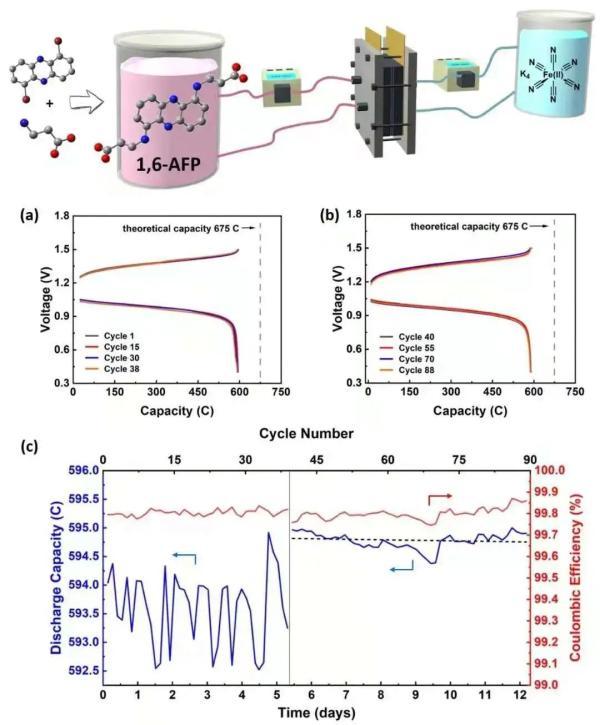
1 M 1,6-AFP (pH 8) 的电池循环表现
“在实验测试99天之后,通过核磁及电化学手段并没有观察到任何化学分解。该液流电池具有极低的容量衰减(0.0015%每天),在长时间充放电的状态下,仅表现出每年0.5%的衰减。”王盼说。
研究人员表示,这是目前所有报道中,水系有机液流电池低衰减的新纪录保持者,在水系储能系统中具有重要应用价值。
来源:科技日报 文中图片由西湖大学提供
来源: 科技日报
新纪录!西湖大学利用氨基酸实现高储能
《原清华大学生物学教授颜宁在科学技术实验上的探索与创新》
1996年-2000年清华大学生物科学与技术系学士;
2000年-2004年美国普林斯顿大学分子生物学系,博士,导师为结构生物学家、清华大学教授、中国科学院院士、欧洲分子生物学学会外籍会士、美国国家科学院外籍院士、美国人文与科学院外籍院士施一公;
2005年-2007年 美国普林斯顿大学分子生物学系从事博士后研究;
2007年-至今清华大学教授、博士生导师;
2017年5月7日从清华大学证实,颜宁已接受美国普林斯顿大学邀请,受聘该校分子生物学系雪莉·蒂尔曼终身讲席教授的职位。
研究方向
人类基因组中编码蛋白的所有基因约有30%编码膜蛋白。
膜蛋白在一切生命过程中起着关键作用,具有重要的生理功能。FDA批准上市的药物中,约50%的作用靶点为膜蛋白。
因此,对膜蛋白结构与功能的研究具有极高的生物学意义及医药应用前景。
转运蛋白(transport proteins)是膜蛋白的一大类,介导生物膜内外的化学物质以及信号交换。脂质双分子层在细胞或细胞器周围形成了一道疏水屏障, 将其与周围环境隔绝起来。
尽管有一些小分子可以直接渗透通过膜,但是大部分的亲水性化合物,如糖,氨基酸,离子,药物等等,都需要特异的转运蛋白的帮助来通过疏水屏障。
因此,转运蛋白在营养物质摄取,代谢产物释放以及信号转导等广泛的细胞活动中起着重要的作用。
大量疾病都与膜转运蛋白功能失常有关,转运蛋白是诸如抗抑郁剂,抗酸剂等大量药物的直接靶点。
研究主要集中在次级主动运输蛋白的工作机理上。
交替通路模型,被用来解释转运蛋白的工作机理,在这个模型中,转运蛋白至少采取两种构象来进行底物的装载及卸载:
一种向膜外开放,一种向膜内开放。有许多结构和生物物理学证据支持这个模型。
但是,仍有两个最有趣的基本问题没有解决。
第一,主动运输的能量偶联机制是什么?
第二,在转运过程中,是什么因素触发了转运蛋白的构象变化?使用基于结构的研究手段对次级主动运输蛋白进行研究,以期解决转运蛋白工作机理中的基本问题。
主要成就
2014年,颜宁率领的团队在世界上首次解析了人源葡萄糖转运蛋白GLUT1的三维晶体结构。
2015年进一步获得了具备更多构象的GLUT3结合底物和抑制剂的超高分辨率结构,从而清晰揭示了葡萄糖跨膜转运这一基本细胞过程的分子基础。
此外,她还对离子通道结构生物学领域做出重要贡献,解析了电压门控钠离子通道的晶体结构,最近又利用最新冷冻电镜技术获得了最大钙离子通道RyR1的高分辨率结构。
2015年进一步获得了具备更多构象的GLUT3结合底物和抑制剂的超高分辨率结构,从而清晰揭示了葡萄糖跨膜转运这一基本细胞过程的分子基础。
2016年9月-Science-关闭及开放构象的RyR2
2016年9月,颜宁教授研究组与加拿大卡尔加里大学陈穗荣研究组合作在《Science》(DOI:10.1126/science.aah5324)发表研究长文,揭示了已知分子量最大的离子通道Ryanodine受体RyR2亚型处于关闭和开放两种状态的三维电镜结构,探讨了RyR2的门控机制。
通过比较关闭和开放状态的两个结构,发现位于穿膜区域负责通透离子的通道有明显的变化:
在开放构象中,该通道发生扩张,从而使得钙离子能够顺利地从肌质网内部转移到细胞质中。通过对RyR2中每个相对独立的结构域的仔细比较和分析,认为中心结构域极有可能是引发RyR开放的关键,这一发现与之前有关RyR的功能研究结论相吻合。
另外,研究组还获得了分辨率为5.7埃的RyR1开放构象结构,并基于结构比对,初步分析了RyR1的门控机理,有关RyR1的成果已分别发表在《Nature》(Doi:10.1038/nature14063)和《Cell Research》(Doi:10.1038/cr.2016.89)上,有关Cav1.1的论文已分别发表于《Science》(DOI: 10.1126/science.aad2395)和《Nature》(Doi:10.1038/nature19321)杂志上。上述研究与最新的这篇研究论文极大地促进了人们对于兴奋-收缩偶联的理解。
2017年2月,真核生物电压门控钠离子通道的拓扑图和三维电镜结构
2017年2月,颜宁教授研究组在《科学》(Science, DOI: 10.1126/science.aal4326)在线发表了题为“Structure of a eukaryotic voltage-gated sodium channel at near atomic resolution”的研究长文,在世界上首次报道了真核生物电压门控钠离子通道。


 添加微信免费咨询
添加微信免费咨询
