氨基酸被替换
#天津疫情或已在社区持续传播多天# 我们必须对Omicron有清醒的认识
Omicron变异的刺突蛋白具有至少30个氨基酸替换、3个小缺失和1个小插入的特征。值得注意的是,30个氨基酸替换中有15个位于受体结合域(RBD)。在其他基因组区域也有一些变化和缺失。N501Y增加了与ACE2受体的结合,而N501Y与Q498R的结合可进一步增加结合亲和力。所以目前看来,Omicron具有更强的传染性,因为当前mRNA疫苗都是针对刺突蛋白的,而Omicron的刺突蛋白的广泛突变给疫苗的防护力也打了折扣。
11月24日,南非发布了关于新发现的omicron (B.1.1.529),仅仅两天后,也就是11月26日,世界卫生组织(WHO)将其命名为“担忧的变体”。美国于12月1日报告了首例omicron病例,截至12月25日,该变种在美国的病例中占了绝大多数,有些地区的omicron呈现飞天的爆涨,一天的感染人数可以突破百万。
世界各地的专家们仍在收集信息,伦敦帝国理工学院COVID-19应对小组的一份报告计算出,omicron再次感染的风险是delta病毒的5.4倍。根据作者的说法,这意味着在那些已经感染了COVID-19的人中,omicron再次感染的保护可能低至19%。
完全接种疫苗的人也正在经历突破性感染。挪威公共卫生研究所的一个案例报告,11月27日在奥斯陆的一个公司的圣诞晚会,所有与会者报告完全接种疫苗。117名与会者在聚会后接受了回访,其中110人在聚会后两周内被检测出新冠病毒阳性!
好消息也有,伦敦帝国理工学院的一项早期分析发现,与delta相比,感染这种变种的人住院一晚或更长时间的可能性要低40%。
12月22日发表在medRxiv上的一项丹麦研究发现,辉瑞- biontech疫苗对omicron的总体有效性为55.2%,Moderna的有效性为36.7%。虽然如此,12月29日发表在medRxiv上的预印研究发现,与未接种的人相比,接受过两剂强生疫苗的人因omicron而住院的风险估计降低了85%。
如此猛烈的病毒变种,考验着世界人民的耐心。相对于西方已经躺平的政策,我们国家对这种高传染性的变种需要付出多少代价,现在尚难预料,也必然会提出更多的思考。#健康过冬指南#
研究盐胁迫下植物的抗盐机理及其对生长的影响
中国是盐碱地的大国,盐碱地面积占全世界盐碱地总面积的十分之一。盐碱胁迫抑制植物的生长和发育,是农作物减产的主要因素之一。深入挖掘植物抗盐基因并研究其生物学功能,不仅有助于阐明植物盐胁迫应答的分子机制,而且为农作物的抗逆遗传改良提供理论基础和候选基因。
近日,中国科学院成都生物研究所汪松虎课题组在The Plant Journal在线发表了一篇题为The cloning and characterization of Hypersensitive to Salt Stress (HSS) mutant, affected in quinolinate synthase, highlights the involvement of NAD in stress-induced accumulation of ABA and proline 的研究论文,揭示了细胞内众多脱氢酶的辅酶NAD(烟酰胺腺嘌呤二核苷酸)在植物盐胁迫应答中的作用机制。
通过早期EMS化学诱变,该实验室筛选和分离到一个对盐胁迫超敏感的拟南芥突变体植株hss(hypersensitive to salt stress)。利用Mutmap技术鉴定到,hss的单碱基突变位于NAD早期生物合成途径中喹啉酸合成酶(QS)高度保守的NadA的结构域中。QS基因在盐胁迫应答中的功能一直未被揭示,主要原因是该基因的knockout突变体是致死的。该研究报道的hss突变体为该基因的knockdown突变体,点突变导致的氨基酸替换抑制了QS的酶活性,进而显著降低了NAD的生物合成,通过遗传互补和外源添加NAD的方式可以使突变体的盐胁迫超敏感性得到恢复,说明NAD的不足导致了突变体对盐胁迫的超敏感性。
研究进一步揭示了hss突变体中NAD合成不足会显著抑制胁迫诱导并依赖于该辅酶的ABA和脯氨酸的生物合成,而ABA的合成不足会降低胁迫诱导且依赖ABA的抗逆基因的表达,脯氨酸不足会使细胞对渗透压敏感,并诱导ROS的大量积累。有趣的是,外源添加ABA和脯氨酸只能部分恢复不能完全互补hss突变体对盐胁迫的超敏感性,说明NAD影响的其他途径也参与了盐胁迫的应答。该研究不仅克隆和发现了一个新的盐胁迫应答基因,而且揭示了NAD调节盐胁迫应答的部分作用机制。
成都生物所博士魏明为该文的第一作者,研究员汪松虎和副研究员黄维藻为论文的通讯作者。该研究得到国家自然科学基金等的资助。
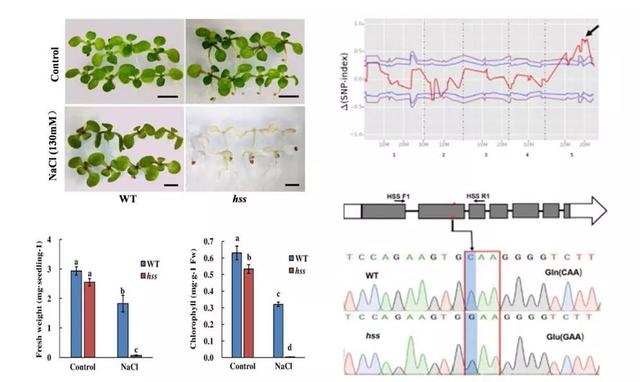
图1.hss突变基因的克隆
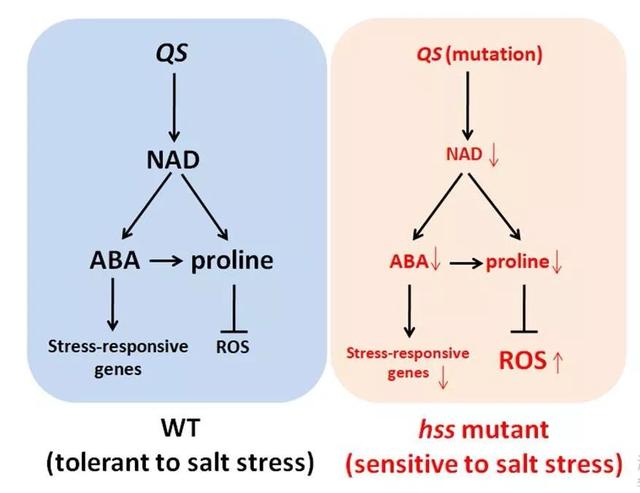
图2.QS基因调控植物盐胁迫应答的分子机制
来源:中国科学院成都生物研究所
科学家解析NAD调控植物盐胁迫应答的作用机制,研究盐胁迫下植物的抗盐机理及其对生长的影响
科普作家Bethany Halford在博客上详细讲述了辉瑞的重磅COVID-19口服抗病毒药Paxlovid的开发过程,这个发现过程是个精彩绝伦的科学故事。
我一直对抗病毒小分子充满兴趣,所以我十分关注这些药物的开发,并一直在微博上报道。我之前讲过开发历经十几年的HIV重磅抗病毒药—HIV衣壳抑制剂GS-6207的发现过程。而这里的高活性抗病毒药Paxlovid的开发,只用了不到两年。其开发过程可以说是抗病毒小分子药物研发的另一个典范。我虽然对药物化学很感兴趣,但毕竟不是药化出身,希望学药化的同行指正。
Paxlovid可将COVID-19住院或死亡的风险降低88%,并且这是目前唯一可以降低病毒载量的小分子抗病毒药。随着高度传染性Omicron突变株导致COVID-19病例在世界范围内激增,医生们希望Paxlovid能成为一些患者的生命防线。上个月底FDA授权了Paxlovid的紧急使用(EUA),联邦政府立刻购买了2000万个疗程的药物。辉瑞宣布计划在今年进行1.2亿个疗程的生产,并寻求FDA的全部通过。
这个药物开发的故事开始于2020年3月13日,辉瑞美国麻省剑桥分布的英国裔药物化学家Dafydd Owen被要求在家上班(WFH),那时辉瑞关闭了大量办公室和实验室,并要求员工在家上班。而Owen的经理让他在家筹划开发抗病毒小分子,以应对疫情。Owen作为资深的药物化学家从英国剑桥大学获得有机合成博士学位,并在辉瑞公司工作了22年。11年前他移居美国,进入辉瑞的麻省剑桥分部。他擅长药物化学最经典的药物,酪氨酸激酶药物的高通量筛选(HTS)及开发。酪氨酸激酶靶点药物的开发,是药物化学领域最经典的开发案例,Janet Rowley发现慢性粒细胞白血病患者有异位形成的费城染色体表达酪氨酸激酶,瑞士诺华公司的靶向酪氨酸激酶的药物格列卫(Gleevec,imatinib)的开发故事被传颂了几十年
在这里之所以要谈格列卫,是因为开发抗病毒和开发抗肿瘤小分子药物具有共性,就是药物往往针对病毒和肿瘤的异常的酶结构,根据酶分子的构象设计和筛选药物。Owen之前没有开发过抗病毒药,对从头开发一种抗病毒药毫无头绪,但是他的酶化学及HTS经验赋予了他独特的创新视角。在周末疯狂补习抗病毒药物开发的同时,辉瑞公司决定优先开发SARS-CoV-2的主要蛋白酶3CL(Mpro)。
3CL的主要功能是切割病毒的复制酶replicase多蛋白pro-protein,经3CL切割后的replicase才具有功能。辉瑞之所以选择该靶点进行开发,主要是因为在2002-2003年非典疫情中,辉瑞开始开发SARS抗病毒药PF-00835231,PF-00835231的靶点是SARS-CoV的蛋白酶。PF-00835231始终没有进行临床试验,因为PF-00835231临床前开发时,SARS疫情已经结束。
PF-00835231是一个药物化学中的多肽类小分子药物,其富含氢键,具有极性表面,无法被肠道吸收,因此要将其改造成为口服SARS-CoV-2药物需要进行一系列化学修饰。这便是Owen团队面临的最大挑战。Owen最终于2020年4月重返实验室,在之后的13个月,他在家里设置了临时办公室,主要设计和讨论如何使PF-00835231及其抗病毒衍生物获得口服特性,其中一个策略是消除氢键供体,Owen团队由此运用了系统化学修饰,逐一消除氢键供体,再检测消除氢键后的每一个化合物的功能。该团队从PF-00835231中消除的第一个氢键供体是α-羟甲基酮。该位点与3CL中的半胱氨酸发生共价反应,因此药化专家推断他们可以将其替换为不是氢键供体的不同反应基团。他们选择了两个系列的化合物:一个具有苯并噻唑-2-基酮作为反应基团,另一个含有腈的反应基团。 直到药物活性实验接近尾声,化学家才在两者之间进行选择。
另一个重要的氢键供体位于PF-00835231的亮氨酸部分。Owen团队决定用可以消除N-H健的环状氨基酸替换该部分。为了实现类亮氨酸结合,该基序还具有一个带有两个甲基的稠合环丙基环。计算机辅助药物设计表明该结构将插入酶结合位点。而幸好这种设计有个先例:先灵葆雅曾在丙型肝炎(HCV)抗病毒药物boceprevir中使用过它。
这个化学修饰实际上是该工作最关键的部分。Owen评价说环化是有机合成中的大决战,它直接这个药物设计的成败,因为一旦分子环化后,化学修饰无法再改变分子构象。事实证明,这一设计是成功的,但代价是消除氢键后,该分子与蛋白酶口袋中的甘氨酸结合减弱,造成了药物活性的降低。为了恢复与甘氨酸的相互作用,研究团队将PF-00835231的吲哚进行了各种置换尝试,包括甲磺酰胺、乙酰胺和三氟乙酰胺。 这三个分子看起来很相似,但只有三氟乙酰胺的置换产物能被肠道吸收。


 添加微信免费咨询
添加微信免费咨询
